北航新闻网5月2日电(记者 冯浩)近日,北京航空航天大学生物与医学工程学院常凌乾团队与合作者研发一种柔性可植入式电子贴片(NanoFLUID),相关成果于2025年4月30日发表于《Nature》杂志。

内脏器官疾病的精准治疗,依赖于高效药物递送方法。然而,现有的药物递送范式面临两大挑战:首先,传统的口服或者静脉给药方式效率有限,药物在全身循环中容易"迷路",难以精准到达病灶部位,并产生对其它器官损伤的风险。其次,大分子药物,如基因药物,很难穿过细胞膜天然屏障。“按照常规的给药方式,相当于吃100块钱的药,可能只有1块钱的药能真正到达病灶区域进行有效治疗,99块钱的药物成分都在循环过程中被无效代谢掉了。”因此,开发精准、安全、高效的靶向器官药物递送技术,是提高临床治疗效果的核心要务。
为解决这一问题,近日,常凌乾团队联合北京大学、香港城市大学、美国伊利诺伊大学厄巴纳-香槟分校(UIUC)、西北工业大学等研究者,报道了一种柔性可植入式电子贴片(NanoFLUID),融合了柔性电子、微纳加工等前沿技术,具有无线控制、极致轻薄和易贴附特点,可以像创可贴一样贴在生物体器官上,将药物精准送达靶器官部位和细胞内部。相关成果以“A battery-free nanofluidic intracellular delivery patch for internal organs”为题,发表于国际顶级期刊《Nature》。北京航空航天大学生物与医学工程学院尹德东博士、北京航空航天大学生物与医学工程学院蒋欣然(博士生)等为第一作者,北京航空航天大学生物与医学工程学院常凌乾教授为通讯作者,北京航空航天大学为第一单位。

该生物电子芯片结构,基于常凌乾团队标签技术——纳米电穿孔,通过结合柔性电子材料,形成5层微纳结构电子贴片,中间层为药仓,可直接附着在器官表面。其独特的“纳米孔-微通道-微电极”的3D结构,可实现低电压下细胞膜安全穿孔,同时,巧妙利用纳米孔道内形成的超高电场强度,将药物分子递送速度提升了上万倍(对比传统的电递送方法)。无源供电模块保证了贴片在植入内脏器官后的实时可控打开细胞膜“通道”,将大分子或基因药物分子以高于传统递送速度安全、快速高效送入目标细胞内(图1)。NanoFLUID还可以通过调控电参数,精准地以微米和微克为单位控制药物进入器官的深度及剂量。
“初期纳米电穿孔这个技术只能用在体外细胞上,而一个器件要想植入体内的话,它一定要具有轻、薄、能够装载药物还能产生电场这几个核心特征。”常凌乾坦言,NanoFLUID的灵感一方面来源于纳米电穿孔这一课题组的标签式技术,另一方面则来源于和柔性电子领域专家的交流,在学术交流中,科研团队逐渐找到了如何将纳米电穿孔加载在微型器件上面的方法。
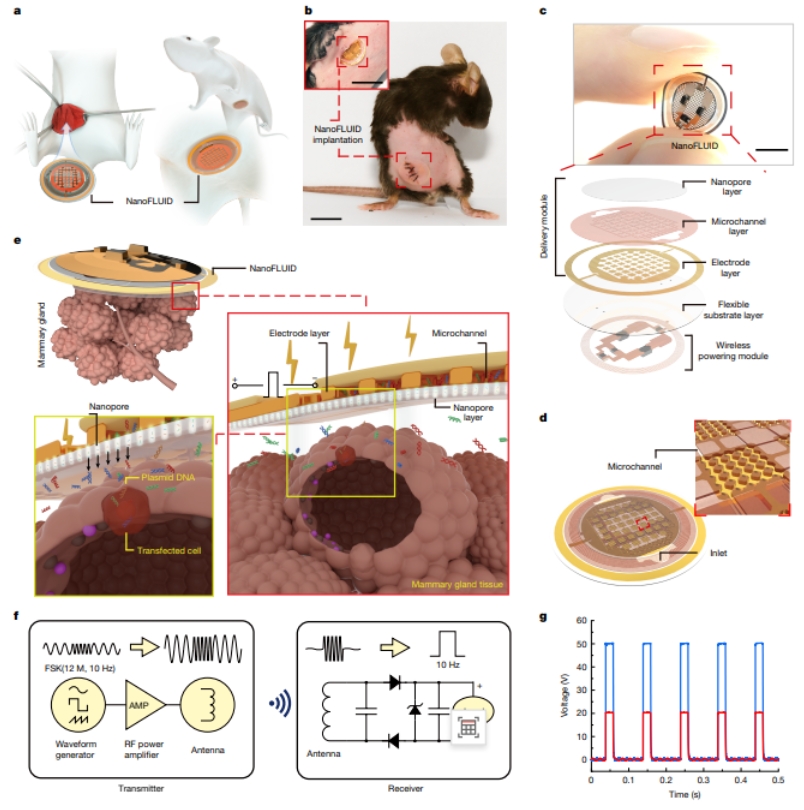
图1. NanoFLUID实现内脏器官精准给药
为了探究电子贴片递送药物的治疗效果,研究团队建立了小鼠急性创伤性肝损伤模型,验证了贴片在肝脏创伤治疗中的疗效。与传统缝合、电灼或水凝胶止血方法相比,贴片实现创口即时止血(贴片治疗组7天存活率100%,而对照组死亡率40%)。此外,通过递送表皮生长因子基因(Egf)显著促进肝细胞再生,使肝功能指标(ALT/AST)在7天内完全恢复正常。病理学分析还显示,贴片治疗组肝脏损伤部位恢复平滑完整,无炎症浸润和纤维化形成(纤维化面积减少80%),远优于其他治疗组。这种创新的“机械封闭+药物治疗”双模式,解决了传统止血方法易导致肝功能损伤的难题,为内脏器官急性创伤救治提供了兼具高效性和安全性的全新治疗方案,展现出显著的临床转化价值(图2)。
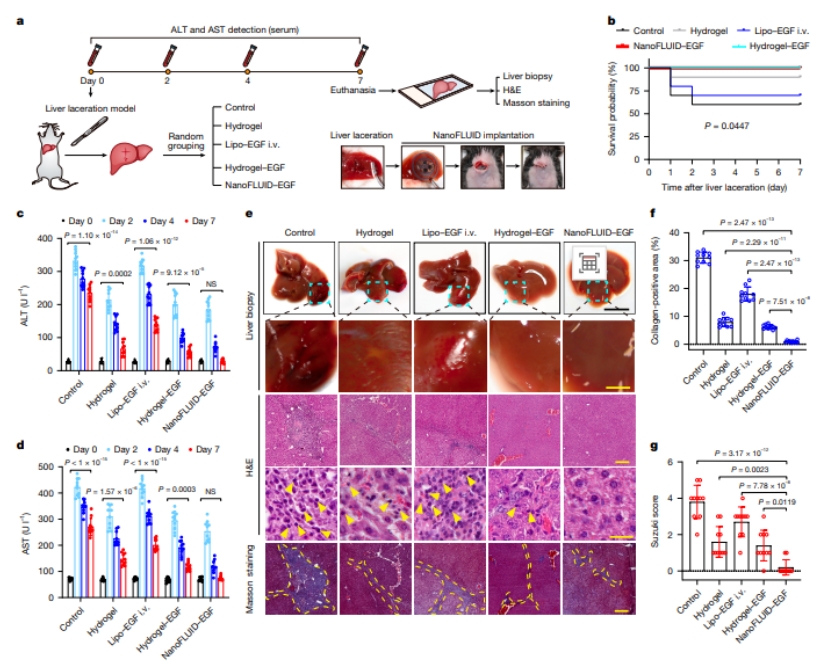
图2. NanoFLUID实现急性创伤性肝损伤高效修复
为进一步论证电子贴片的递送能力,研究团队利用贴片系统,建立了乳腺癌转移驱动基因的高效筛选平台。通过将TCGA数据库中筛选出的50个与乳腺癌转移预后最相关的候选基因构建成基因文库,并利用贴片精准递送至小鼠乳腺组织,研究人员首次实现了在体水平的高通量基因筛选。实验结果分析鉴定出11个在转移灶中显著富集的候选基因,其中DUS2基因表现出最突出的富集特征(表达量达4030 TPM)。功能分析证实,DUS2过表达显著促进肿瘤细胞的蛋白质合成能力和转移潜能,敲降DUS2则可有效抑制转移进程。蛋白质组学分析进一步揭示DUS2因子可能通过调控76个下游靶基因的表达,激活了包括细胞迁移、粘附等在内的多个转移相关通路。该研究为乳腺癌转移机制研究提供了重要工具和新靶点(图3)。
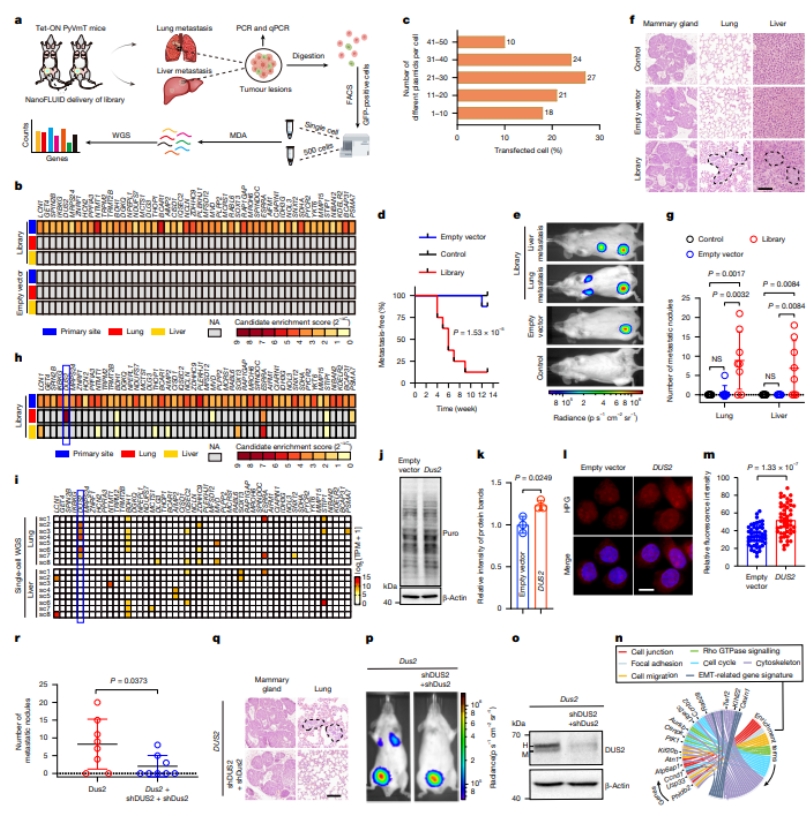
图3. 基于NanoFLUID的乳腺癌转移相关基因高通量筛选
NanoFLUID代表了一项具有范式革新意义的生物电子学突破,为内脏器官靶向治疗开辟了新途径:首先,无源无线设计实现了对深部器官的精准干预;其次,突破传统给药方式的细胞膜屏障限制,显著提升药物递送的时效性;此外,该平台技术具有极强的拓展性,既能针对癌症、创伤等重大疾病开发新型治疗方案,又可作为研究工具推动基础医学发现。
该技术目前已在北航实现转化,应用在在医学美容、皮肤创伤修复等领域,孵化了基于纳米电穿孔的无创Ultra-NEP透皮导入仪(图4),实现高效药物递送。

图4. 基于NanoFLUID的技术转化:Ultra-NEP透皮导入仪
从2017年就开始研究这一课题,“坚持”是常凌乾讲述科研过程中提到的高频词。“从 2019 年正式启动项目,到 2022 年投稿,在项目实施过程中,器件的整体设计和加工工艺,随着生物体内应用场景的增加在不断地更新和完善。从 2022 年投稿到 2025 年接收,又历经两年多的修稿,这项成果才得以发表。” 常凌乾回忆起来,感慨万千。器件加工难度极大,载药仓既要小巧,又要能装够量药物,还要和无源电场模块完美连接。团队尝试了很多种方案,最终选择在载药仓里加入多个微柱,形成微流道,利用虹吸效应,让药物能快速装进和排出。
更让常凌乾印象深刻的是初次投稿《Nature》后收到的审稿意见多达40多条,审稿人对器件的安全性、控制精度和使用场景等提出了疑问。“当时有个审稿人针对临床提出意见,觉得吃药打点滴没创伤,为什么要动手术把贴片植入器官?” 于是,科研团队做了大量实验来论证贴片在很多场景下都具有独特优势。比如在内脏器官损伤修复时,临床一般都需要进行外科手术缝合或电灼,速度慢、治疗效果也不理想,贴片能大幅加快治疗速度和效率;在肿瘤治疗里,有些器官上布满了弥散式小肿瘤,无法通过手术切除,只能靠化疗或放疗,而贴片可以直接贴在器官上,进行原位药物导入,治疗效果和安全性都比放疗、化疗好得多。就这样,他们通过做大量的实验和充分论证,写了近250页的补充内容,将审稿人的顾虑一一打消。
面向未来,常凌乾透露,团队正在研究可降解材料,以便贴片在使用后可自行降解。此外,团队还致力于提高贴片与复杂器官表面的贴合度,以及开发无创植入方式,如利用微型机器人或微导管对贴片进行精准导航到目标位置。
“这项成果是一个非常典型的医工交叉的成果,它涉及到了细胞生物学、基因工程、电子、力学、微纳加工和材料学等学科,体现了北航的现代生物医学工程学科群逐渐地向多学科有机融合的发展趋势。”谈及项目和科研经验,常凌乾感触颇深:“做科研,一定要沉得住气,去做那些能真正解决难题的研究。要敢于逆向思维,仔细琢磨领域内那些一直没被解决的核心问题。只要坚持,就一定能取得胜利。”
附:北航作者简介
第一作者

尹德东,北京航空航天大学生物与医学工程学院客座研究员
现为北航生物与医学工程学院客座研究员,合作导师:常凌乾教授。博士毕业于中国科学院大学,国家卫生健康委科研所助理研究员。主要研究方向包括细胞生物学、生物芯片和纳米电穿孔,近五年发表SCI论文10余篇,如Nature, Nature Electronics, Advanced Material, ACS Nano等。

蒋欣然,北京航空航天大学生物与医学工程学院博士生
硕士毕业于康奈尔大学生物医学研究院药理系,研究方向为在体药物递送系统。已发表SCI论文10余篇,如Nature, Nature Electronics, Advanced Materials等。
通讯作者

常凌乾,北京航空航天大学生物与医学工程学院教授 大数据精准医疗工信部重点实验室主任
博士毕业于美国俄亥俄州立大学,曾于美国北德克萨斯大学担任助理教授。研究方向包括细胞生物芯片、纳米电穿孔技术。以通讯作者身份发表 Nature, Nature Electronics, Nature Photonics, PNAS, Nature Communications, Science Advances等期刊论文80余篇;获工信部杰出青年、Micro Nano Engineering青年科学家奖、中国科技新锐人物奖等荣誉。技术已转化,已完成两轮融资,申报医疗器械两项。
论文链接:https://www.nature.com/articles/s41586-025-08943-x
(素材来源:生物与医学工程学院)
(审核:李建伟)
编辑:贾爱平