北航新闻网1月28日电(通讯员 王津墨)传统药物递送方法(如口服、静脉注射),由于递送路径长、时空可控性差,在面向结构复杂的器官(如卵巢、肾脏)疾病治疗时,长期存在着“药物递送效率低、安全风险高”等问题。以卵巢疾病(如卵巢早衰)为例,现有递送技术,由于缺乏时空精准性,易导致生殖细胞意外转染,从而产生不可预知风险。至今,该领域缺乏一种高效且全器官时空可控的递送技术。在北航,青年教师带领博士生科研团队,不同学院间学科交叉合作产出,在这一领域取得突破。

2026年1月28日,国际顶级学术期刊Cell报道了北京航空航天大学医学科学与工程学院常凌乾教授团队,联合机械工程及自动化学院徐晔教授团队,在前沿交叉医学领域取得的最新进展:《An organ-conformal, kirigami-structured bioelectronic patch for precise intracellular delivery》。他们联合北京大学第一医院、中国医学科学院肿瘤医院、香港城市大学、美国伊利诺伊大学等单位,在该领域取得重大突破:团队研发出一款柔性可植入生物电子器件(POCKET),如同一个智能“口袋”,通过个性化定制,可实现完美贴合于复杂形状的器官表面,并通过“纳米电穿孔效应”,实现安全、高效、精准的全器官药物递送或基因转染。
北京航空航天大学作为第一完成单位,成果第一作者为北航生物与医学工程学院卓百博士后、香港城市大学博士后王玉琼,共同一作为北航机械工程及自动化学院博士生杜腊梅、北航生物与医学工程学院博士生吴晗,通讯作者为北京航空航天大学教师常凌乾、徐晔、樊瑜波。

研究背景:始于临床
该工作始于一个令医生深感无力的临床问题:对于遗传性卵巢基因突变(如BRCA1)的患者,临床指南一般建议切除双侧卵巢和输卵管,以避免癌症发生,但这意味着永久丧失生育能力。“医生,就真的没有别的办法了吗?”患者经常含泪追问。然而,现有的基因治疗技术,如病毒载体,因存在整合入生殖细胞基因组、干扰人类基因库的潜在风险,在卵巢这类敏感器官上应用被视为禁区。
针对该问题,研究团队将目光转向物理方法——电穿孔,即施加电场在细胞膜上,瞬时打开细胞膜,理论上可以通过精确控制递送深度,实现针对卵巢表面的体细胞的基因干预,从而避免生殖细胞污染。然而,卵巢表面崎岖不平,沟壑纵横,传统电穿孔器件无法实现“高共形贴合”于器官表面,导致药物递送可控性差、效率低,无法从根本上精准治疗,解决这类“禁区难题”。
突破瓶颈:剪纸艺术
面对这一核心问题,常凌乾团队与徐晔团队合作,从传统“剪纸”艺术中汲取灵感,创造性地提出了“器官定制化剪纸共形理论”。该理论首次建立了剪纸结构几何参数(如单元尺寸、铰链宽度)与器官曲率、材料属性之间的定量关系,为器官进行“三维扫描”,并“智能生成”最合身的外衣尺寸,从而指导设计出在特定曲率器官上既能完全共形、又最大限度保留功能面积的剪纸贴片,有效覆盖率>95%,攻克了“高共形”与“高覆盖”不可兼得的难题。
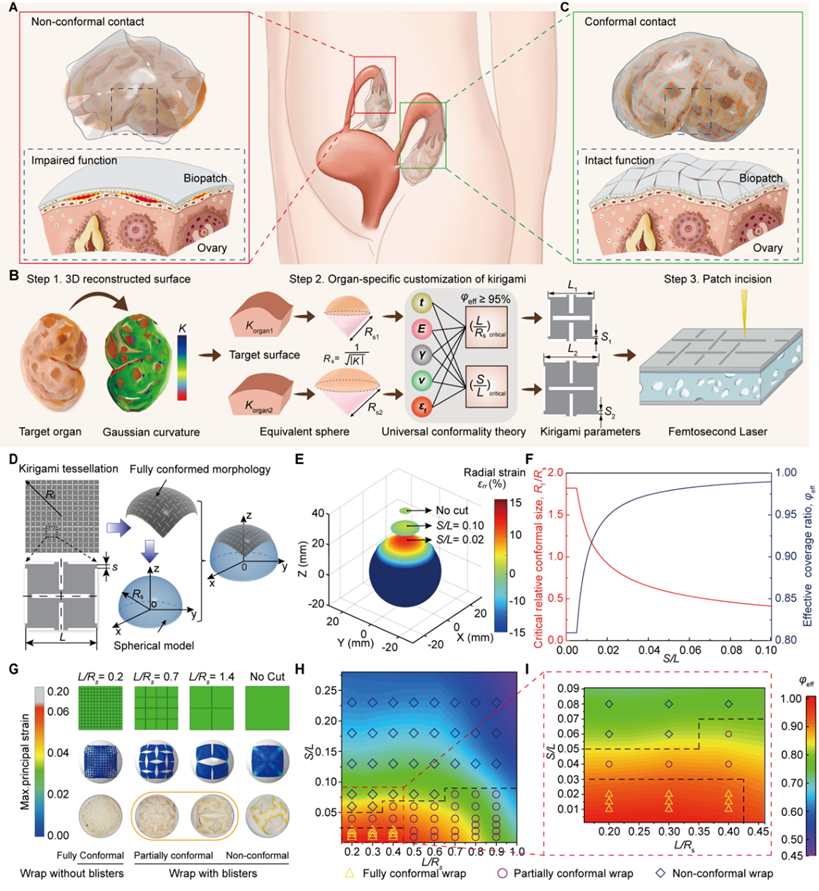
图1基于剪纸结构的共形理论
器官的电子外衣:精准高效递送
POCKET器件采用四层功能化设计:与组织直接接触的纳米孔阵列薄膜、用于负载药物的水凝胶储药层、负责电场分布的银纳米线电极层,以及起封装支撑作用的柔性基底层。这四层结构通过飞秒激光精密加工,被赋予定制化的剪纸拓扑,从而能够在不同物种的多种器官表面——如卵巢、眼球、肾脏——实现高度共形、大面积的贴合。
这种“电子外衣”般的紧密贴合,使得器件底层的纳米孔与目标细胞形成精准的空间并列。在施加低电场时,高阻抗的纳米孔道产生显著的电场聚焦效应,在细胞膜局部可逆、安全的打开细胞膜。同时,孔道内形成的高强度电场梯度会驱动强大的电泳力,将药物或基因载荷的递送速度提升近千倍,从而在低工作电压下同步达成高效率、高安全性的细胞内递送——实现“纳米电穿孔”效应。
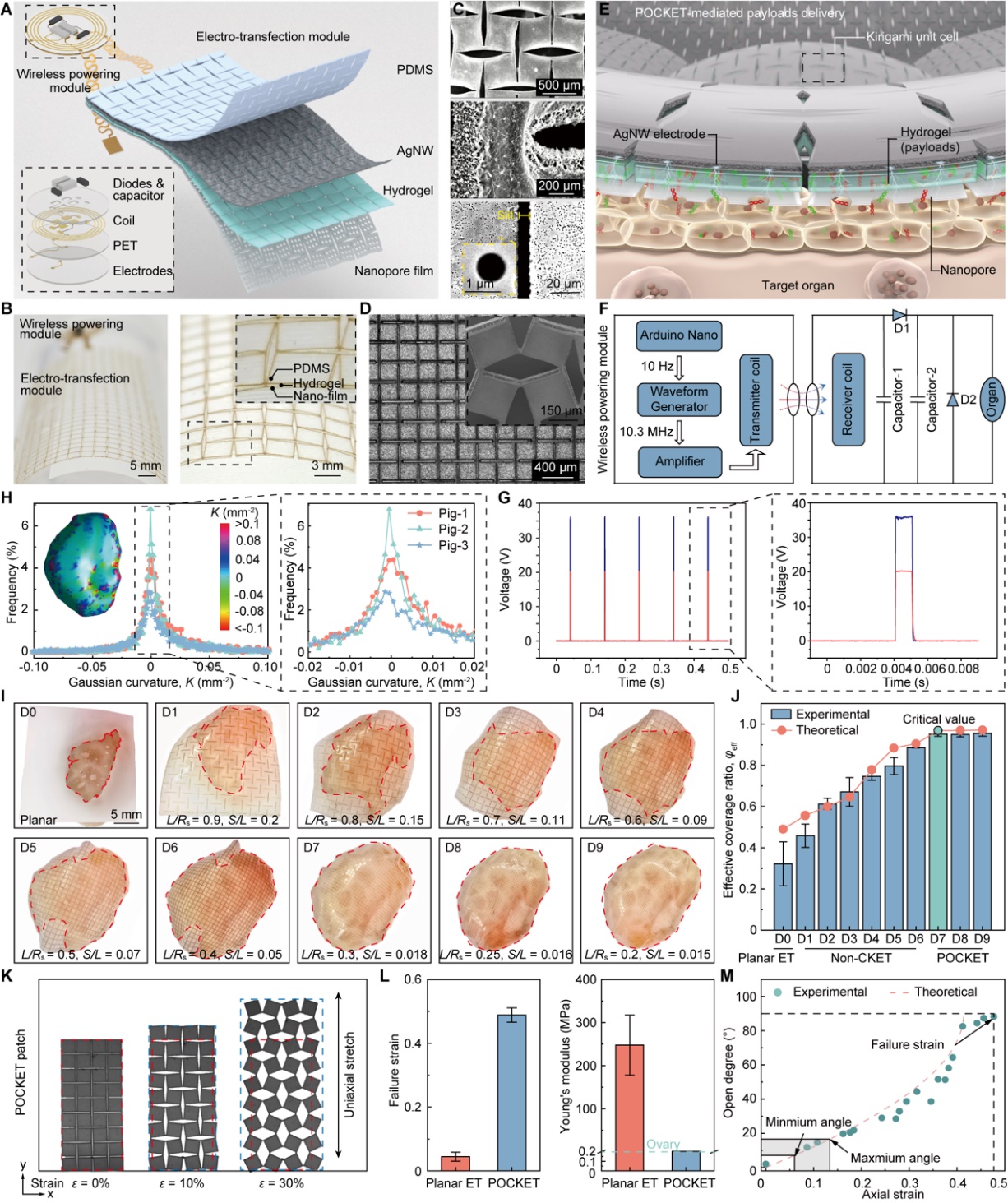
图2:定制化POCKET器件
疗效验证(1):守护生育希望
研究团队在多种动物模型和离体人类组织上验证了POCKET的强大功能。首先,结合其高度空间控制能力,创立了一套在卵巢上的治疗策略,在模拟人BRCA1突变的小鼠模型中,POCKET成功将功能性BRCA1-Plasmid递送至全卵巢表面细胞(OSE)内,产生长效的降低癌症发生风险的目的,而不会进入卵巢内的生殖细胞,干扰基因组。同时刺激OSE细胞分泌定制的包裹有Brca1 mRNA的外泌体(不具有基因组编辑能力),向内改善卵巢早衰的症状。这一策略使得治疗后卵巢的DNA损伤显著降低,癌症发生率在一个治疗周期内降至零。更重要的是,卵巢的激素分泌功能、卵子质量及生育能力均得到恢复,产生的后代健康。这为携带致癌基因突变的女性提供了无需切除卵巢即可防癌、并保留生育力的有效方案。
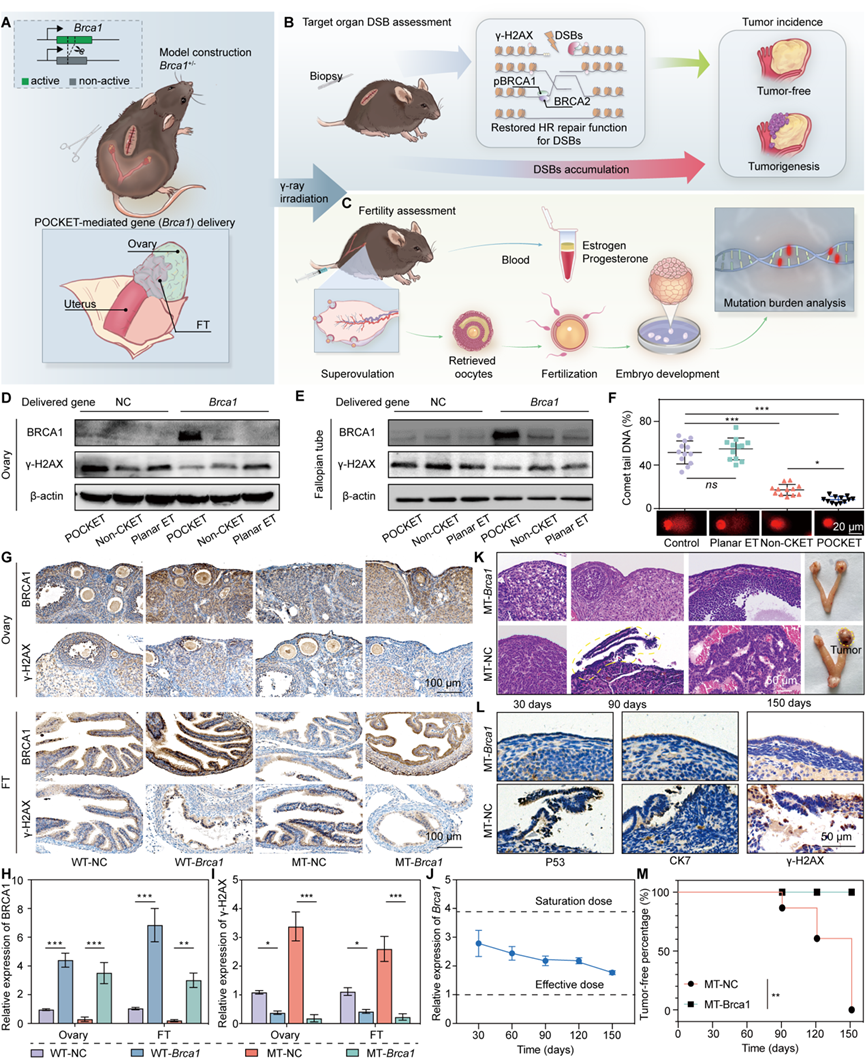
图3. POCKET实现卵巢的精准基因治疗
疗效验证(2):修复器官损伤
常见的肾移植手术中,肾脏缺血再灌注导致损伤,会引起肾功能不可逆的功能问题。为解决该问题,POCKET被植入肾脏表面,与肾脏器官进行大面积共形,进行持续、稳定地全肾脏器官水平上递送抗炎药物地塞米松。长期实验结果显示,与口服给药相比,POCKET局部递送在显著促进肾小管修复、保护肾功能的同时,几乎完全避免了口服激素引发的骨质疏松、免疫力下降等全身性副作用,展示了其在慢性病管理中的优势。
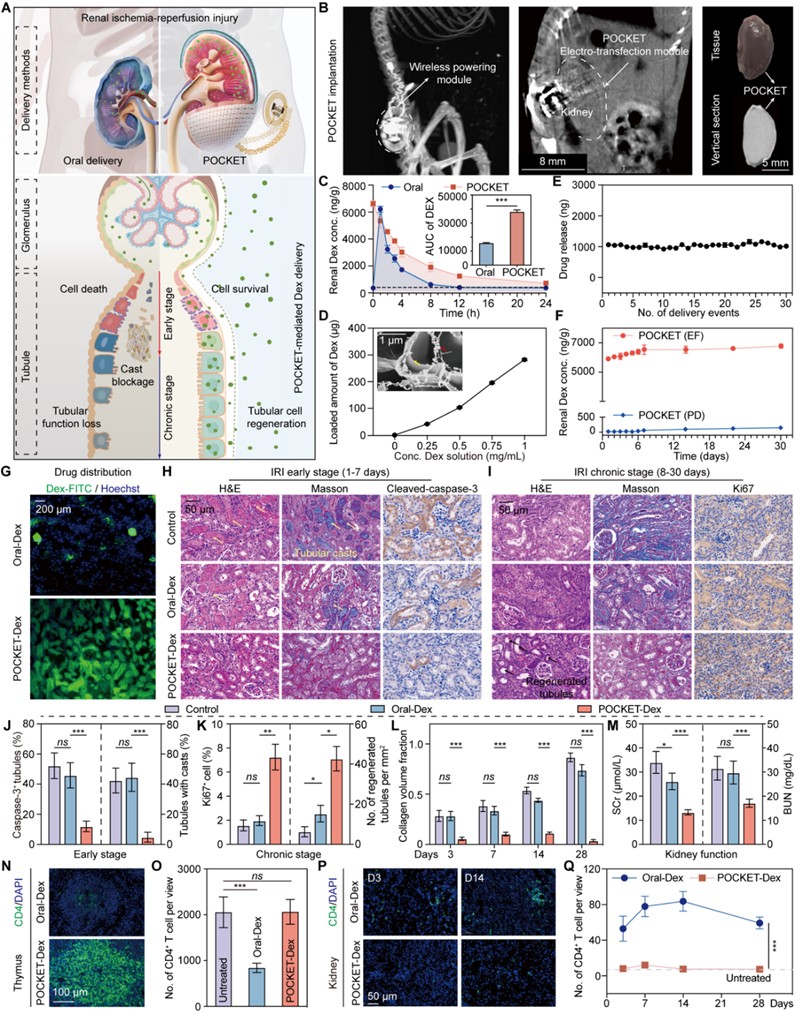
图4 POCKET实现时间可控的肾脏长期给药
POCKET技术转化和临床应用
POCKET平台技术为卵巢癌预防、器官损伤修复等疾病精准治疗提供了新工具,通过融合柔性电子、微纳加工、无线供能等技术,实现了植入式器件的精准操控与长效工作,可扩展至肝脏、心脏、肺部等多种内脏器官的疾病治疗、再生修复和功能调控,为未来生物电子医学的发展开辟了新范式。
在国家自然科学基金杰青项目和科技部重点研发专项的持续支持下,常凌乾团队成功实现了“NEP纳米电穿孔”技术从实验室到产业的跨越。基于该核心技术孵化的高科技产业化公司已完成多轮融资。首款转化产品——“Ultra-NEP超透仪”已应用于皮肤健康等领域。未来,团队将进一步拓展其在医疗级设备领域的应用。

图5.基于POCKET的技术转化成果:Ultra-NEP超透仪
论文链接:https://www.cell.com/cell/abstract/S0092-8674(25)01434-5
(审核:李德玉)
编辑:史越