北航新闻网2月19日电(通讯员 杨贤达)硬脊膜(spinal dura mater)是保护脊髓、防止脑脊液泄漏和硬膜外粘连的关键组织。然而,在脊柱手术和神经外科手术中,硬脊膜损伤导致脑脊液泄漏是常见的术后并发症,发生率高达4%至32%。目前,临床上用于硬脊膜修复的材料存在诸多局限性,如来源有限、降解速率与组织再生不匹配、易引发炎症和硬膜外粘连等。因此,开发一种力学特性适宜、且既能促进硬膜再生又能抑制硬膜外粘连的新材料,一直是该领域的研究热点。近日,北京航空航天大学生物与医学工程学院、生物力学与力学生物学教育部重点实验室、北京生物医学工程高精尖创新中心樊瑜波教授、李晓明教授和李林昊副教授团队,在著名综合性期刊《Nature Communications》上发表了新型硬脊膜修复材料的最新成果“Janus decellularized membrane with anisotropic cell guidance and anti-adhesion silk-based coatings for spinalduralrepair”。樊瑜波教授、李晓明教授和李林昊副教授为该文的共同通讯作者,生医学院博士研究生毕雪薇(目前为北京大学材料学院博士后)和北航材料学院博士研究生毛智南(目前为香港中文大学博士后)为该论文的共同第一作者,北京航空航天大学为第一完成单位。
该研究开发了一种新型的Janus小肠黏膜下层(SIS)膜材料,通过在SIS表面涂覆丝素基水凝胶涂层,实现了对硬脊膜修复和防止硬膜外粘连的双重功能:内层丝素蛋白(SF)和甲基丙烯酰化丝素蛋白(SilMA)复合(SFMA)微沟槽涂层可引导细胞定向生长,促进硬脊膜再生;外层的甲基丙烯酰化透明质酸(HAMA)和SilMA复合涂层则能有效抵抗蛋白吸附和细胞粘附,抑制硬膜外纤维化粘连(图1)。
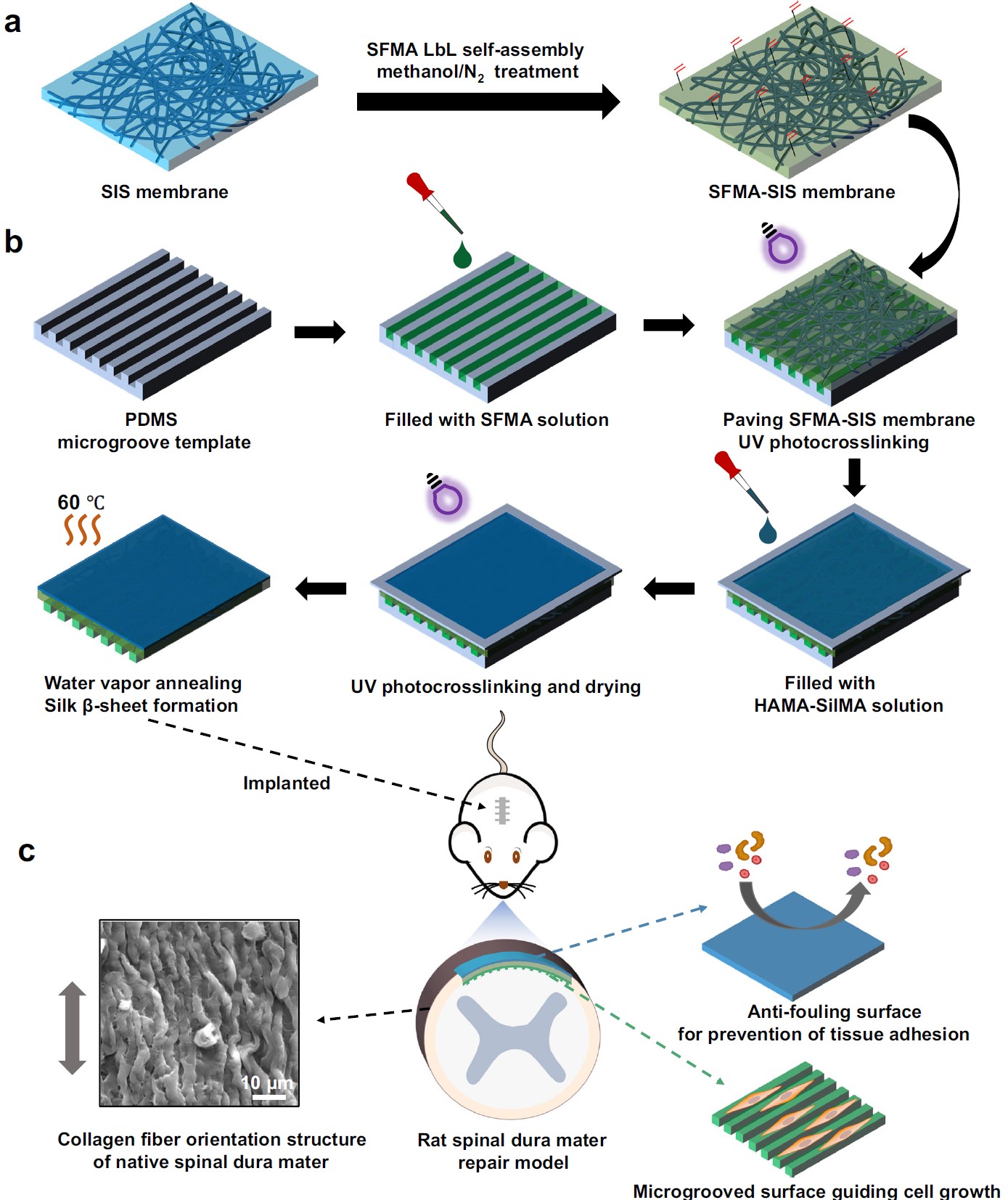
图1.硬脊膜再生的Janus小肠黏膜下层(SIS)膜的设计与制备
该研究为了使SFMA微槽涂层吸水后结构稳定,利用了水蒸汽热处理工艺。如图2所示,与未处理的微槽涂层相比,经过水蒸汽处理后的SFMA微槽涂层的二级结构发生变化,进而导致其力学和结构稳定性有显著提升。
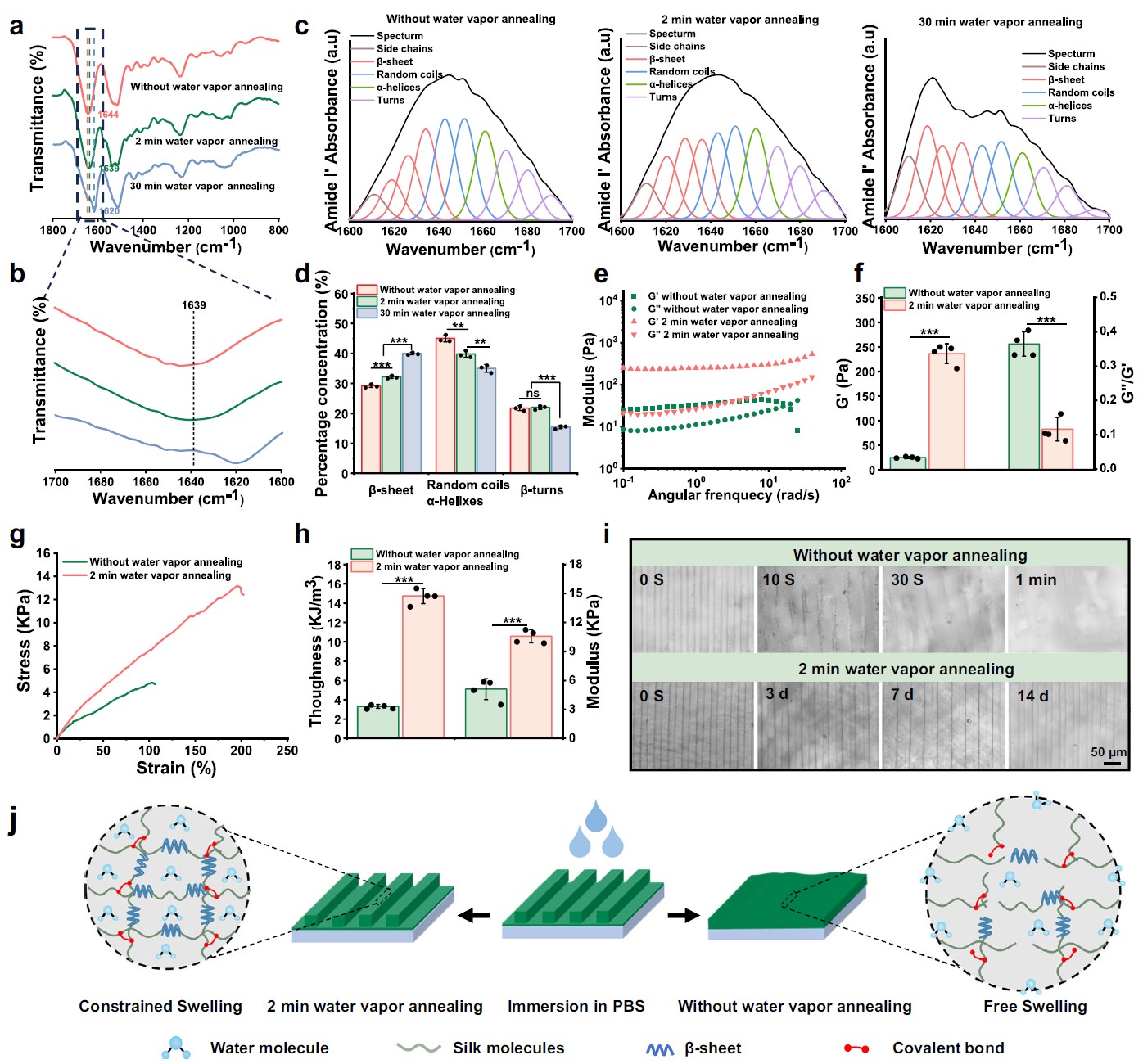
图2.水蒸汽退火提高了SFMA微槽涂层的力学性能和结构稳定性
该研究进一步研究了SFMA微槽涂层与SIS底物的截面结合力和稳定性。如图3所示,SFMA微槽涂层和SFMA改性SIS基底之间的结合强度最大,同时,水蒸汽退火后的SFMA微槽涂层与未经处理的涂层相比,其结合强度有所提高。这些结果表明,光固化反应的共价键和水蒸汽处理介导的β-折叠物理相互作用协同提高了SFMA微槽涂层和SIS基底之间的界面结合强度。
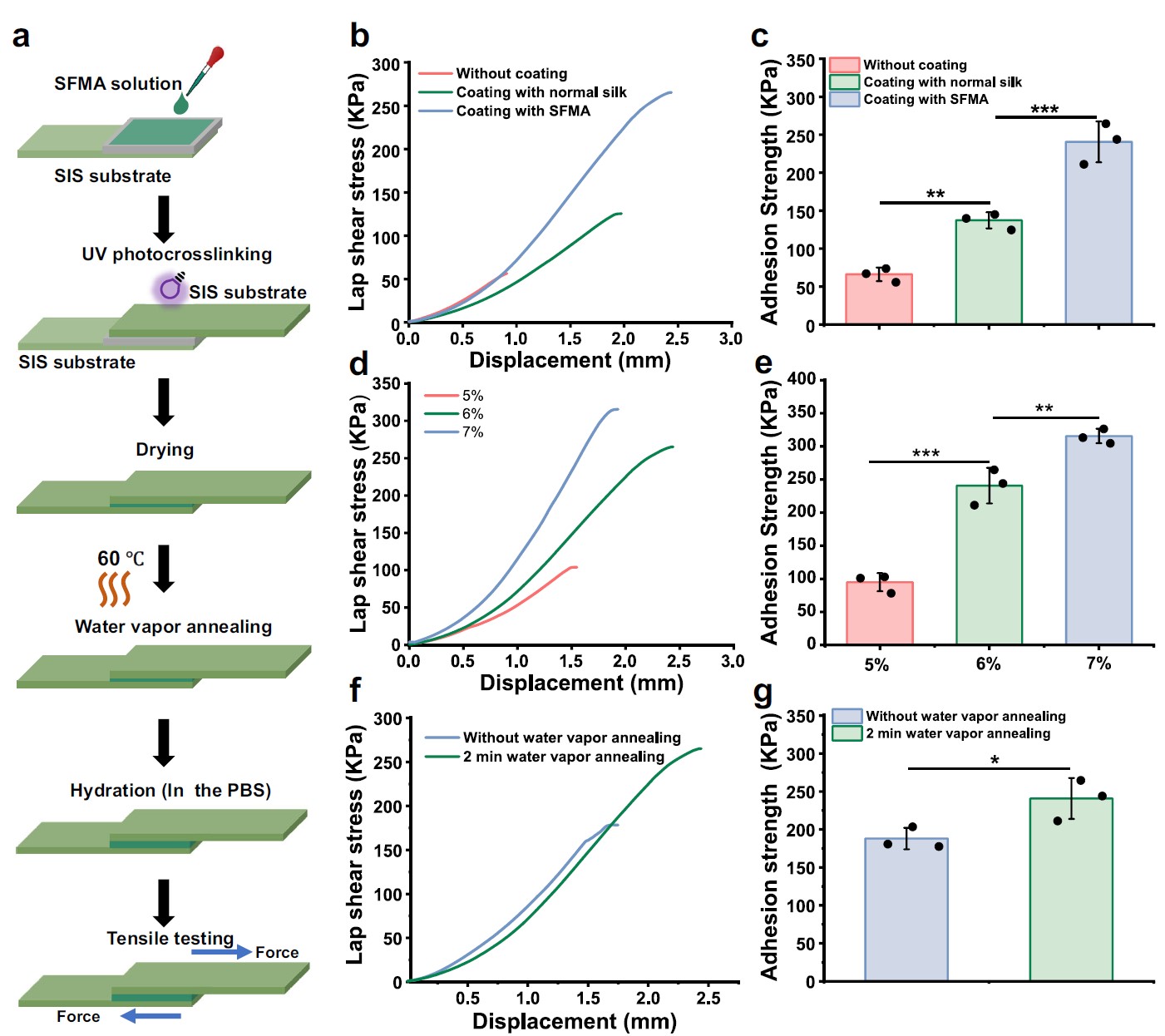
图3.光固化和水蒸汽退火处理增强了SFMA微槽涂层和SIS基底之间的界面结合强度
通过SD大鼠皮下模型验证了微沟槽的稳定性以及与组织整合情况,如图4所示,在植入后28天,微沟槽的结构开始崩解,这表明SFMA微沟槽已经发生了生物降解。此外,大量宿主细胞分布在微沟槽内,且SFMA微沟槽表面和SFMA-SIS表面均显示出类似的纤维囊形成,这表明微沟槽涂层与宿主组织整合良好。此外,SFMA微沟槽表面和SFMA-SIS表面均以Arg-1阳性巨噬细胞为主,这表明SFMA微沟槽涂层类似于生物活性SIS膜,能够促进巨噬细胞向M2表型极化。
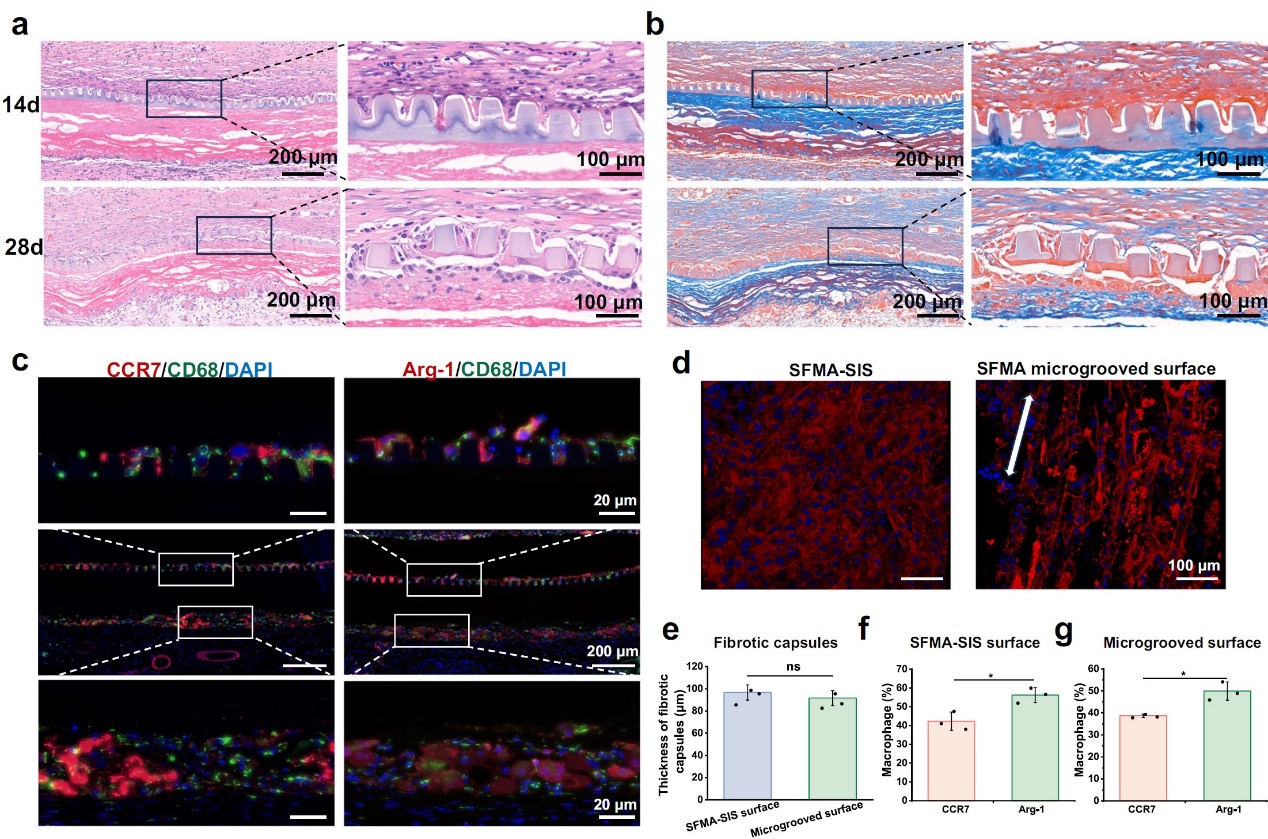
图4.SFMA微沟槽涂层与宿主组织整合良好,并促进了M2型巨噬细胞极化
组织学评估显示(图5),在植入14天后,HAMA-SilMA涂层表面作为保护性屏障,与宿主组织明显分离,并有效阻止了宿主细胞和组织的侵入,从而减少组织粘连的程度。HAMA-SilMA侧的巨噬细胞显示出更高的M1表型,然而,与SFMA-SIS侧相比,HAMA-SilMA侧显示出更薄的纤维囊和更低的α-SMA阳性成纤维细胞表达。

图5.HAMA-SilMA涂层抑制了组织内生长,并减轻了纤维化形成
该研究采用椎板切除术模型来制造硬脊膜缺损,以评估Janus SIS膜在体内的治疗效果(图6)。从脊髓组织的宏观图像可以看出Janus涂层组的外观与天然硬脊膜相似。同时通过H&E染色和Masson三色染色可以看出Janus SIS组的硬膜缺损区域观察到连续的新生成胶原组织,与正常硬膜组织高度相似。磁共振成像(MRI)结果表明术后8周Janus SIS显示出脊髓与硬脊膜外组织之间更清晰的边界。α-SMA和胶原蛋白I的免疫荧光染色进一步评估硬膜外纤维化粘连,与SIS组相比,Janus SIS组硬膜外组织中的α-SMA阳性细胞数量更少;对照组硬膜外区域被广泛密集的胶原蛋白I占据,而植入SIS和Janus SIS的组中胶原蛋白I的表达显著降低。
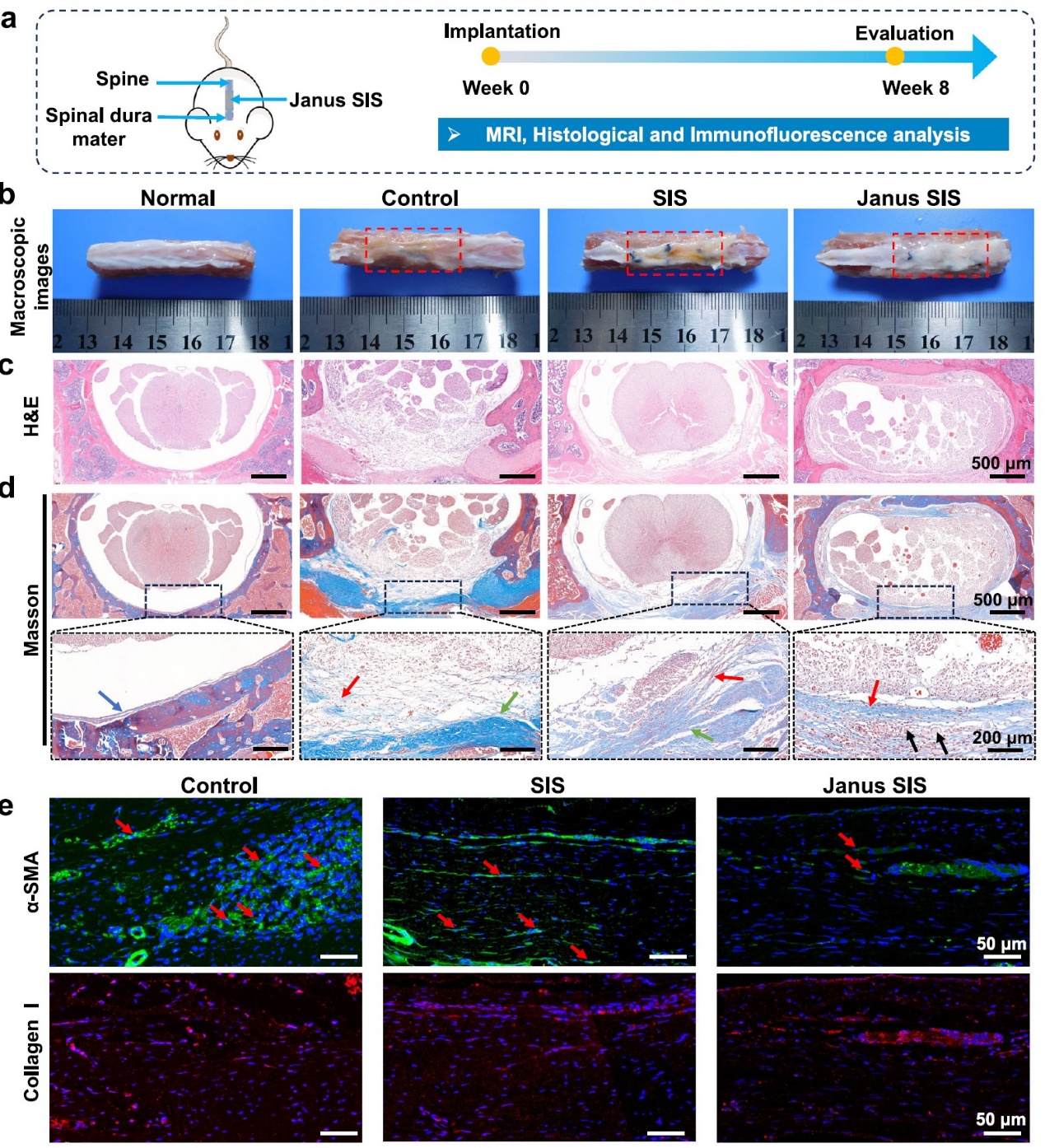
图6.在大鼠脊髓硬膜缺损模型中,Janus SIS膜显著增强了硬膜的原位再生
综上所述,本研究不仅为硬脊膜修复提供了一种全新的生物材料解决方案,还为开发具有仿生结构和功能的Janus材料提供了新的思路。这种新型Janus膜材料的设计理念和制备方法,有望在其他软组织修复领域得到广泛应用,为临床治疗提供更有效、更安全的材料选择。
该研究得到了国家自然科学基金(T2288101, 11827803,12332019, 32371405, 32171345和32201114)等基金的支持。
原文链接:https://www.nature.com/articles/s41467-025-56872-0
(审核:李德玉)
编辑:贾爱平